
Рис. 1. Элизабет Блэкберн, Кэрол В. Грейдер и Джек В. Шостак
Лауреатами Нобелевской премии по физиологии и медицине в 2009 году стали Элизабет Х. Блэкберн, Кэрол У. Грейдер и Джек У. Шостак . В пресс-релизе, выпущенном 5 октября 2009 года, Нобелевский комитет обосновал свой выбор, обнаружив, как хромосомы защищены теломерами и ферментом теломеразы. История этих исследований восходит к 1978 году, когда Блэкберн заинтересовался хромосомами реснитчатого простейшего (нынешнее название королевства протистов, тип orzęski) - тетрагимена (рис. 2).
Рис. 2. Свободноживущий меловой Tetrahymena termophila, похожий на туфельку ( Paramecium caudatum ), в которой теломерные последовательности были впервые обнаружены. Во время индивидуального развития 5 хромосом тетрагимена фрагментируется примерно до 250-300 активных транскрипционно-акроцентрических хромосом со средней длиной 700 000 нуклеотидных пар, образуя так называемые макронуклеус (источник: Википедия). Рис. От: Показывает последовательность генома Cili. Уникальные особенности модельного эукариота. Робинсон Р., PLoS Biology, том 4/9/2006, с304. http://dx.doi.org/10.1371/journal.pbio.0040304
Два года спустя на научной конференции она впервые представила, что линейные хромосомы эукариотического организма имеют характерную структуру. Эта презентация заинтересовала Шостака, который в то время занимался конструированием искусственных хромосом у дрожжей. Конструкция дрожжевой искусственной хромосомы была необходима из-за сложного процесса свертывания и модификации полипептида, который происходит в эукариотических клетках. Только таким путем можно получить, например, гормон роста или эритропоэтин с сохраненными биологическими свойствами. В те годы бактериальные хромосомы, представляющие собой кольцевую молекулу ДНК и не имеющие свободного конца, были уже хорошо известны. В искусственных бактериальных минихромосомах, напоминающих цитоплазматическую конструкцию, также кольцевые бактериальные плазмиды смогли разместить фрагменты генов, модифицирующих бактериальные свойства. Например, рядом с геном устойчивости к антибиотикам, главной причиной существования плазмид, можно было разместить фрагмент ДНК человека, кодирующего полипептид белка человека.
Шостак переместил теломерную последовательность из тетрагимены в дрожжевую хромосому и обнаружил, что они были скопированы в этом совершенно отдаленном эволюционном организме. Четыре года спустя Грейдер, аспирант Blackburn, идентифицировал ферментативное свойство фракции клеточного белка, копируя только повторяющиеся последовательности теломер. Они привели к открытию теломеразы, фермента, который использует встроенную матрицу РНК для копирования нового теломерного шнура. Грейдер упоминает, что ее открытие произошло в Рождество 1984 года. В той же команде нынешние лауреаты Нобелевской премии получили премию Ласкера в сентябре 2006 года (с. Нобелевская премия по медицине или физиологии в 2007 году ), что уже давно облегчало Нобелевскому комитету отбор победителей в области физиологии или медицины, а иногда и химии.
Почти полвека назад Леонард Хейфлик провел эксперимент, в котором он показал, что в клеточной культуре фибробласты кожи делятся только примерно в 50 раз, после чего деления клеток прекращаются, и клетки демонстрируют признаки старения. В 1978 году Элизабет Блэкберн во время исследования хромосом Trzebhymena thermophila обнаружила, что на их концах, называемых теломерами, имеется несколько сотен повторений нуклеотидного мотива CCCCAA. Пытаясь объяснить, зачем нужны эти странные конечные последовательности, ее тогдашняя аспирантка Кэрол Грейдер искала способ скопировать теломеры во время деления клетки. В то же время Джек Шостак, который перевел Tetrahymena telomeres в дрожжевую клетку, заявил, что созданные им дрожжевые минихромосомы благодаря присутствию видозависимых теломер защищены от повреждения и деградации. Фермент теломераза активен во всех делящихся клетках и исчезает в дифференцированных клетках, которые перестали делиться. Недостаток теломеразы в делящихся клетках вызывает укорочение конечных сегментов хромосом - теломер. В отсутствие теломеразы укорочение теломер с примерно 400 пар нуклеотидов до нуля у дрожжей появляется после 120 поколений, а у людей - после примерно 50 клеточных делений. Дальнейшие деления становятся невозможными, потому что геном реплицирует и разрушает хромосомы во время репликации генома. Комплексы ферментов, которые восстанавливают ДНК после неправильного разрушения обеих цепей ее молекулы, соединяют концы хромосом с другими их фрагментами. Накопленные хромосомные мутации являются причиной старения клеток и прекращения их деления.
У мышей, у которых отсутствует активность теломеразы, важность этого фермента наблюдалась в процессе онкогенеза. Оказывается, несмотря на общее ускорение старения и бесплодие, у этих животных также могут появляться опухоли. Очевидное противоречие между прекращением клеточного деления и неопластической трансформацией, основной чертой которой является способность делить раковые клетки без ограничений, нашло свое объяснение. Среди нескольких мутаций, вызывающих раковую трансформацию, у мышей, у которых отсутствует активность теломеразы, было постоянное появление тех, которые восстанавливали ее, что препятствовало ее дальнейшей регуляции. Просто неактивный ген теломеразы, благодаря хромосомной транслокации, был обнаружен вместо другого гена с высокой генетической экспрессией. Также стоит помнить, что даже максимальная активность теломеразы сама по себе не является причиной неопластической трансформации. Он наблюдается в клетках зародышевой линии, из которых возникают ооциты и сперматоциты, и, кроме сперматогонии, он исчезает во время эмбриональной дифференцировки клеток. Он также присутствует в эмбриональных и индуцированных плюрипотентных стволовых клетках, гарантируя их основную особенность - самообновление (с. Индуцированные плюрипотентные стволовые клетки - надежда регенеративной медицины ). В индуцированных плюрипотентных стволовых клетках, в которых активация теломеразы происходила под влиянием так называемых Протеины яманаки, скорее всего, отсутствие последующего ингибирования активности теломеразы способствует образованию опухолей тератомы. И наоборот, клонирование животных из соматических клеток (с. Индуцированные плюрипотентные стволовые клетки - надежда регенеративной медицины ), когда дефицит активности теломеразы приводит к ускоренному старению организма, что наблюдалось у запоминающейся овцы Долли.
Механизм, с помощью которого теломеры защищают концы хромосом до их объединения с другими фрагментами молекул ДНК, хорошо изучен. Теломеры состоят из 100-1000 повторов мотива CCCTAA (общая формула Cn> 1 (A / T) 4> m> 1 во всех организмах), и, кроме того, богаче комплементарной цепи гуанина простирается за конец хромосомы в виде 14-16 нуклеотидов. Благодаря активности белка, называемого TRF2, он сплетается примерно за 5-10 тысяч нуклеотидов до конца хромосомы между одними и теми же повторениями, что наиболее близко напоминает образование петли на конце веревки (рис. 3).
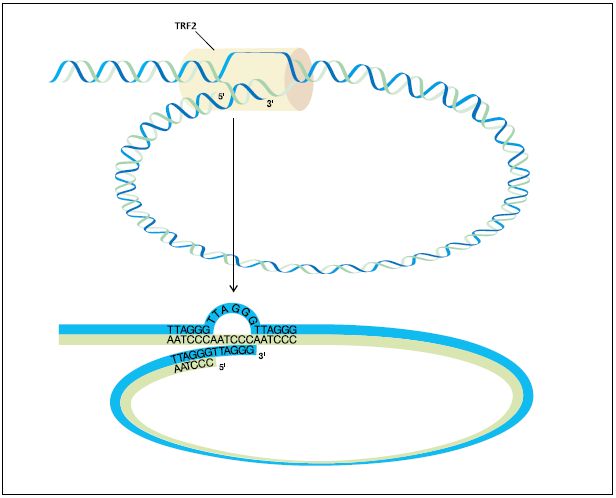
Рис. 3. Теломерная организация. Несколько сотен копий нуклеотидной последовательности повторов и одна свободная цепь ДНК позволяют сформировать петлю, стабилизированную белком TRF2 (в человеческом TERF2). Он имитирует бесконечные бактериальные хромосомы, у которых нет проблем с копированием или свободными концами, склонными к перестройке генетического материала.
Таким образом, концы хромосом защищены от повреждения и пытаются связать их с фрагментами сломанных хромосом. Копирование теломер требует специального механизма. ДНК реплицируется в клетке в виде относительно коротких сегментов из примерно 1000 нуклеотидов. Процесс происходит одновременно в обоих несвязанных потоках, где начальные точки репликации обозначены специальными последовательностями. В теломере конец его цепи с 3 '> 5' фосфодиэфирной связью не может служить источником репликации, поскольку новые нуклеотиды должны быть добавлены к свободной 3 'дезоксирибозной гидроксильной группе в присутствии матрицы.
Теломераза - это фермент, содержащий молекулу РНК длиной более 150 нуклеотидов. Это частично дополняет поток, имеющий проблему с репликацией, что позволяет копировать его (рисунок 4).
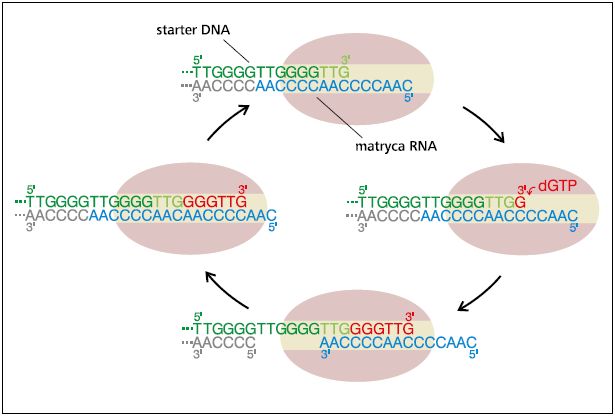
Рис. 4. Механизм удлинения теломер этими ломеразами. Субъединица РНК, составляющая теломеразу, комплементарна выступающей одиночной цепи теломера (3'-конец ДНК). После гибридизации этих молекул активность обратной транскриптазы удлиняет свободный 3'-конец цепи ДНК на основе комплементарной РНК-матрицы. Точные нуклеотиды образуют одно и то же повторение последовательности, и теломераза может двигаться к 3'-концу ДНК, чтобы повторить цикл синтеза. Восстановление второй цепи теломерной ДНК инициируется образованием шпилечной структуры из цепи теломеразы, синтезированной теломеразой. Доступный свободный 3'-конец становится началом добавления нуклеотидов, которые восполняют потерю противоположной цепи ДНК-зависимыми ДНК-полимеразами.
Следовательно, фермент представляет собой рибонуклеопротеин с обратной транскриптазной активностью, поскольку он предписывает РНК в ДНК. В настоящее время проблема физиологической регуляции активности теломеразы вновь стала предметом медицины. При регенеративной терапии, заключающейся в колонизации организма делящимися стволовыми клетками, после диверсификации в органе клетки следует гасить теломеразой. Фермент состоит из двух субъединиц: кодируемой человеком РНК геном TR (также называемой TERC ) и субъединицы каталитического белка, кодируемой геном TERT . Экспрессия TR высока во всех клетках, а в опухолевых клетках она может быть в 5 раз выше. Однако активность фермента ограничена экспрессией гена TERT , количество транскриптов мРНК которого оценивается в зрелых клетках для 2-5 молекул.
Кроме того, комплекс теломеразы содержит около 13 других белков, большинство из которых соединяются с субъединицей РНК. Они служат для стабилизации теломеразы, ее ядерной локализации (белковая субъединица, образующаяся в цитоплазме), взаимодействия с продуктами генов-супрессоров опухолей и онкогенами. Они также включают шапероны (белки, сопровождающие трансляцию и облегчающие сворачивание полипептида, например, p90) и контрольные белки клеточного цикла. Следовательно, изменения активности теломеразы под влиянием стероидных гормонов - эстрогенов усиливают ее, а гестагены - подавляют. Функция четырех из этих белков остается неизвестной.
Некоторые врожденные заболевания, при которых нарушается активность теломеразы, включают врожденный дискератоз - заболевание, общие симптомы которого связаны с тканями, требующими постоянного обновления, такими как кожа, слизистая оболочка желудочно-кишечного тракта, костный мозг. Дефицит клеточной пролиферации проявляется нарушением пигментации кожи, дистрофией ногтей, олигодонтии, скудными волосами, лейкоплакией слизистых оболочек и панцитопенической анемией. Миелодисплазия является одним из основных симптомов этого заболевания. Фактически это набор заболеваний, вызванных мутациями гена TR или TERT или генов белков, которые входят в комплекс теломеразы ( TINF2, DKC1, NOLA2 и NOLA ). В зависимости от мутантного гена, заболевание может наследоваться доминантно ( TR, TERT, TINF2 ) в половой ( DKC1 ) или рецессивной ( NOLA2 и NOLA3 ) манере . Еще одной особенностью врожденного дискератоза является повышенная склонность к раку, связанная с хромосомной нестабильностью. Среди описанных к настоящему времени около 500 пациентов с врожденным дискератозом совокупный риск развития рака (в основном плоскоклеточного рака) достигает 40-50%.
Вторым примером человеческого заболевания, связанного с частичным дефицитом теломеразы, является редкая (1:20 000-50 000 рождений) хромосомная аберрация, известная как синдром крикодеатита, из-за аномальной структуры гортани, которая является причиной характерного плача новорожденных. При этом заболевании происходит удаление короткого плеча хромосомы 5. (5p15.2), в которой находится ген TERT. Не ясно, какие из симптомов этого клинически сильно изменчивого дизефического синдрома, включая микроцефалию, задержку умственного развития и черепно-лицевые пороки развития, зависят от сниженной активности теломеразы. В культуре лимфоцитов в лимфоцитах укорочение теломер наблюдается у пациентов с синдромом крикета, а в культурах хромобаз - переломах хромосом, которые исчезают после введения в клетки теломеразы.
Чтобы полностью отразить неоднозначную роль теломеразы, стоит упомянуть, что лечение, направленное на ингибирование этого фермента, в настоящее время проходит клинические испытания. Это ДНК-вакцины - плазмиды или аденовирусы, которые кодируют теломеразу и вызывают клеточный ответ Т-клеток против опухолевых клеток с высокой экспрессией теломеразы (например, GRNVAC1, Geron) или препаратов теломеразы, полученных из родительских половых клеток. Также рассматриваются нуклеотидные аналоги в качестве ингибиторов теломеразы. Текущие эксперименты указывают на эффективное снижение скорости пролиферации, например рака простаты после ингибирования активности теломеразы.

