- Общая характеристика [ ред. | ред. код ]
- Старые методы [ ред. | ред. код ]
- Получение из изопропилового спирта [ ред. | ред. код ]
- Метод прямого окисления пропилена [ ред. | ред. код ]
- Кумол-гидропероксидний способ [ ред. | ред. код ]
- Другие методы [ ред. | ред. код ]
- Окислительно-восстановительные реакции [ ред. | ред. код ]
- Присоединение нуклеофилов к карбонильной группе [ ред. | ред. код ]
- Реакции по α-позиции [ ред. | ред. код ]
- Реакции конденсации [ ред. | ред. код ]
- Другие реакции [ ред. | ред. код ]
- Патофизиологически влияние [ ред. | ред. код ]
- Влияние на животных [ ред. | ред. код ]
- Влияние на человека [ ред. | ред. код ]
- Воздействие на кожу [ ред. | ред. код ]
- Попадание в организм и поведение в нем [ ред. | ред. код ]
- «Анализ на ацетон» [ ред. | ред. код ]
open wikipedia design.
ацетон Название по IUPAC пропанон Другие названия диметилкетон, 2-пропанон, пропан-2-он Идентификаторы номер CAS 67-64-1 PubChem 180 номер EINECS 200-662-2 номер EC 200-662-2 KEGG D02311 Название MeSH Acetone ChEBI CHEBI: 15347 RTECS AL3150000 SMILES CC (C) = O InChI 1S / C3H6O / c1-3 (2) 4 / h1-2H3 номер Бельштейна 635680 номер Гмелина 1466 Свойства молекулярная формула С3Н6O молярная масса 58,079 г / моль молекулярная масса 58 а. о. м. Внешний вид Летучая бесцветная жидкость запах характерный плотность 0,79705 г / см (15 ° C) Тпл -94,9 ° C Ткип 56,5 ° C Давление насыщенного пара 179,63 мм рт. ст. (20 ° С) кислотность (p K a) 24,2 основность (p K b) -10,2 диэлектрическая проницаемость (Ε) 21,4 показатель преломления (N D) 1,35998 вязкость 0,36 мПа · с (при 10 ° С) дипольный момент 2,80 Термохимия Ст. энтальпия
образование Δf H o 298 -248,4 кДж / моль ()
-217,1 кДж / моль (газ) [1] Ст. энтальпия
сгорания Δc H o 298 -1787 кДж / моль () [2] Ст. энтропия S o 298 199,8 Дж / (моль · K) ()
295,3 Дж / (моль · K) (газ) [1] теплоемкость , C op 126,3 Дж / (кмоль · К) ()
74,5 Дж / (моль · K) (газ) [1] опасности ПДК ( Украина ) 200 мг / м3 ЛД50 3000 мг / кг (мыши, перорально) Индекс ЕС 606-001-00-8 Классификация ЕС  F
F  Xi NFPA 704 температура вспышки -17 ° C температура самовоспламенения 500 ° C взрывные границы 2,15% -13,00% Связанные вещества Связанные вещества бутанон , изопропиловый спирт Если не указано иное, данные приведены для веществ в стандартном состоянии (за 25 ° C, 100 кПа) Инструкция по использованию шаблона Примечания карточки
Xi NFPA 704 температура вспышки -17 ° C температура самовоспламенения 500 ° C взрывные границы 2,15% -13,00% Связанные вещества Связанные вещества бутанон , изопропиловый спирт Если не указано иное, данные приведены для веществ в стандартном состоянии (за 25 ° C, 100 кПа) Инструкция по использованию шаблона Примечания карточки
Ацетон, пропанон (от лат. acetum - уксус) - первый представитель гомологического ряда алифатических кетонов . формула (CH3) 2CO.
Общая характеристика [ ред. | ред. код ]
Бесцветная летучая жидкость с характерным запахом. Неограниченно смешивается с водой и полярными органическими растворителями , Также в ограниченных пропорциях смешивается с неполярными растворителями.
Ацетон является ценным промышленным растворителем и благодаря небольшой токсичности он получил широкое применение при производстве лаков , взрывчатых веществ , лекарственных средств . Он является исходным сырьем в многочисленных химических синтезах. В лабораторной практике его применяют как полярный апротонный растворитель Для приготовления охлаждающих смесей вместе с сухим льдом и аммиаком , Ацетон очень полезным для мытья химической посуды.
Ацетон является одним из продуктов метаболизма в живых организмах, в частности, человека . Он является одним из компонентов так называемых ацетоновых тел , Которых в крови здорового человека содержится крайне мало, однако при патологических состояниях (длительное голодание, тяжелая физическая нагрузка, тяжелая форма сахарного диабета ) Их концентрация может значительно повышаться и достигать 20 ммоль / л ( кетонемия ) [3] .
В Украине ацетон, согласно Постановлению Кабинета Министров от 5 декабря 2012 N 1129 «Об утверждении перечня наркотических средств, психотропных веществ и прекурсоров», является прекурсором , В отношении которого устанавливаются меры контроля. Кроме того таким же мерам контроля подлежат вещества, содержащие не менее 50% ацетона [4] .
Ацетон, один из самых простых и самых важных кетонов , Впервые обнаруженный в 1595 году немецким химиком Андреасом Либавием при сухой перегонке ацетата свинца . Но только в 1832 году Жан-Батист Дюма и Либих точно определили его природу и состав. к 1914 года ацетон получали почти исключительно путем коксования древесины , Но повышенный спрос на него во время первой мировой войны очень быстро привел к созданию новых методов производства.
Старые методы [ ред. | ред. код ]
Старейший метод промышленного производства ацетона заключался в сухой перегонке ацетата кальция , Который образуется при нейтрализации известью древесного уксуса , Который образуется при коксовании древесины [5] . Сейчас этот метод уже не применяется, так как ацетон в этом случае содержит слишком много примесей, а исходный материал дефицитный .
Известны также способы получения ацетона путем бактериального расщепления углеводов ( крахмала , сахаров , мелассы ), Причем как побочные продукты образуются бутиловый или этиловый спирт [6] [7] [8] . Ацетон и бутиловый спирт получают в мольном соотношении от 2: 1 до 3: 1.
2 C 6 H 12 O 6 ⟶ CH 3 COCH 3 + CH 3 (CH 2) 3 OH + 5 CO 2 + 4 H 2 {\ displaystyle \ mathrm {2C_ {6} H_ {12} O_ {6} \ longrightarrow CH_ {3} COCH_ {3} + CH_ {3} (CH_ {2}) _ {3} OH + 5CO_ {2} + 4H_ {2}}}
В Германии был разработан технологический процесс производства ацетона на основе уксусной кислоты [9] . При 400 ° С через контакты с церия пропускали уксусную кислоту:
2 CH 3 COOH → 400 o C, C e CH 3 COCH 3 + CO 2 + H 2 O {\ displaystyle \ mathrm {2CH_ {3} COOH {\ xrightarrow {400 ^ {o} C, \ Ce}} \ CH_ {3} COCH_ {3} + CO_ {2} + H_ {2} O}}
Такой ацетон отличается особой чистотой.
Ацетон также производят из ацетилена прямым синтезом:
2 CH ≡ CH + 3 H 2 O ⟶ CH 3 COCH 3 + CO 2 + 2 H 2 {\ displaystyle \ mathrm {2CH {\ equiv} CH + 3H_ {2} O \ longrightarrow CH_ {3} COCH_ {3} + CO_ {2} + 2H_ {2}}}
Ацетилен вступает во взаимодействие с водяным паром при 450 ° С в присутствии катализаторов (в частности оксида цинка или композита Fe2O3-ZnO) [10] [11] [12] [13] .
Получение из изопропилового спирта [ ред. | ред. код ]
Одним из главных методов получения ацетона является дегидрогенизация изопропилового спирта [14] [15] [16] :
CH 3 CH (OH) CH 3 ⟶ CH 3 COCH 3 + H 2 {\ displaystyle \ mathrm {CH_ {3} CH (OH) CH_ {3} \ longrightarrow CH_ {3} COCH_ {3} + H_ {2}} }
Дегидрогенизация протекает при 350-400 ° С в присутствии таких катализаторов Как сплав железо - медь - цинк [17] , оксид цинка или оксид цинка с 4,5% карбоната натрия [18] , Медь, свинец и другие [19] [20] . вследствие эндотермической характера реакции процесс ведут в трубчатом реакторе, узкие длинные трубки которого обогреваются дымовыми газами. Производительность процесса возрастает при повышении давления (около 2,7-3,4 атмосферы ).
активность катализатора постепенно снижается из-за отложения на его поверхности сажи и смолистых веществ. Регенерация катализатора заключается в обжиге углеродных отложений кислородом , разбавленным инертными газами .
В последнее время все чаще ацетон получают путем окисления изопропилового спирта воздухом . При этом также образуется перекись водорода :
CH 3 CH (OH) CH 3 + O 2 ⟶ CH 3 COCH 3 + H 2 O 2 {\ displaystyle \ mathrm {CH_ {3} CH (OH) CH_ {3} + O_ {2} \ longrightarrow CH_ {3} COCH_ {3} + H_ {2} O_ {2}}}
Этот метод играет определенную роль при производстве глицерина при отсутствии хлора . В качестве катализатора при проведении процесса применяют серебро , медь , никель , платину и другие.
В этом процессе воздух, насыщенный парами изопропилового спирта, пропускается над тонким слоем катализатора при температуре 400-650 ° C. Продукты реакции быстро охлаждают, и конденсат после нейтрализации небольших количеств уксусной кислоты дистиллированных. Выделенный технический ацетон ректификують , А непрореагировавшего изопропиловый спирт возвращают на окисление.
Реакция окисления изопропилового спирта сильно экзотермическая и ее трудно контролировать. Поэтому рекомендуется в одной реакции объединять и окисления, и дегидрогенизации, для того чтобы суммарный тепловой эффект приближался к нулю.
Метод прямого окисления пропилена [ ред. | ред. код ]
Разработана и внедрена в промышленности технология прямого синтеза ацетальдегида с этилена [21] [22] [23]
CH 2 CH 2 + P d C l 2 + H 2 O ⟶ CH 3 CHO + P d + 2 HC l {\ displaystyle \ mathrm {CH_ {2} CH_ {2} + PdCl_ {2} + H_ {2} O \ longrightarrow CH_ {3} CHO + Pd + 2HCl}}
может также служить для непосредственного получения ацетона с пропилена . В этом случае пропилен (или богатая пропиленом смесь газов) под действием раствора катализатора PdCl2 и CuCl2 в хлоридной кислоте превращается в ацетон. Восстановленный катализатор снова окисляется воздухом. При этом протекают следующие реакции:
CH 2 CHCH 3 + P d C l 2 + H 2 O ⟶ CH 3 COCH 3 + P d + 2 HC l {\ displaystyle \ mathrm {CH_ {2} CHCH_ {3} + PdCl_ {2} + H_ {2} O \ longrightarrow CH_ {3} COCH_ {3} + Pd + 2HCl}} 2 C u C l 2 + P d → H 2 O 2 C u C l + P d C l 2 {\ displaystyle \ mathrm {2CuCl_ {2} + Pd {\ xrightarrow {H_ {2} O}} \ 2CuCl + PdCl_ {2}}}
2 C u C l + 2 HC l + 1/2 O 2 ⟶ 2 C u C l 2 + H 2 O {\ displaystyle \ mathrm {2CuCl + 2HCl + 1 / 2O_ {2} \ longrightarrow 2CuCl_ {2} + H_ {2} O}}
Выход составляет 92-94% при 90-120 ° С и давлении 9-12 кгс / см². Как побочные продукты образуются 0,5-1,5% пропионового альдегида (Пропаналя) и ~ 2% моно- и дихлороацетонив. Предполагают, что реакция идет через комплекс [PdCl2 (OH) C3H6] -, который в присутствии воды гидролитически расщепляется на ацетон, палладий и хлорную кислоту [24] . Агентами повторного окисления будут CuCl2 или FeCl3, а также смеси обоих соединений [25] .
Реакцию можно проводить при комнатной температуре , Но повышенные температуры ускоряют процесс. В большинстве случаев рН раствора составляет от 3 до 4. Давление также благоприятно влияет на ход реакции. Обычно работают с очень разбавленным раствором PdCl2 (частично вместе с ацетата меди ) [26] . Использование концентрированного раствора PdCl2 ускоряет реакцию.
модифицированные катализаторы акролеина применяются и при прямом окислении пропилена в ацетон. Катализаторы на основе MoO3 или Bi2O3 в присутствии H3PO4 или H3BO3 при 375 ° С дают рядом с ацетальдегидом, уксусной кислотой, формальдегидом , этилацетатом и акролеин также и ацетон [27] , Причем положительного влияния оказывает добавления серебра [28] . Можно использовать фосфоромолибдат висмута на Al2O3 и фосфоромолибденову кислоту на SiO2 (260 ° С, 1 с) [29] .
Кумол-гидропероксидний способ [ ред. | ред. код ]
Этот способ также является одним из основных промышленных способов получения ацетона, он на 40% дешевле метода получения ацетона с изопропилового спирта. Исходными продуктами служат бензол и пропилен .
алкилирования бензола пропиленом осуществляют в присутствии катализатора хлорида алюминия при температуре 50 ° С. В качестве катализаторов использовали также концентрированную сульфатную кислоту , фтороводорода , фторид бора и другие.
C 6 H 6 + CH 3 - CH = CH 2 ⟶ C 6 H 5 CH (CH 3) 2 {\ displaystyle \ mathrm {C_ {6} H_ {6} + CH_ {3} {-} CH {=} CH_ {2} \ longrightarrow C_ {6} H_ {5} CH (CH_ {3}) _ {2}}}
окисление кумола проводится кислородом воздуха при 4-5 атмосферах и 110-120 ° С, при этом образуется гидропероксид кумола .
C 6 H 5 CH (CH 3) 2 + O 2 ⟶ C 6 H 5 C (CH 3) 2 OOH {\ displaystyle \ mathrm {C_ {6} H_ {5} CH (CH_ {3}) _ {2} + O_ {2} \ longrightarrow C_ {6} H_ {5} C (CH_ {3}) _ {2} OOH}}
Гидропероксид кумола при температуре 30-60 ° С в присутствии примерно 0,1% серной кислоты разлагается на фенол и ацетон:
C 6 H 5 C (CH 3) 2 OOH → H 2 SO 4 C 6 H 5 OH + CH 3 COCH 3 {\ displaystyle \ mathrm {C_ {6} H_ {5} C (CH_ {3}) _ {2 } OOH {\ xrightarrow {H_ {2} SO_ {4}}} C_ {6} H_ {5} OH + CH_ {3} COCH_ {3}}}
Другие методы [ ред. | ред. код ]
Ацетон можно получить каталитическим расписанию паров уксусной кислоты при повышенной температуре (400-450 ° С). катализаторы - карбонат кальция или бария , оксиды кальция , алюминия , тория , урана , цинка , соли марганца и другие.
2 CH 3 COOH + O 2 ⟶ CH 3 COCH 3 + CO 2 + H 2 O {\ displaystyle \ mathrm {2CH_ {3} COOH + O_ {2} \ longrightarrow CH_ {3} COCH_ {3} + CO_ {2} + H_ {2} O}}
Другим известным методом является каталитическая дегидрогенизация паров этанола при температуре 450-500 ° С. Катализаторами процесса является оксид железа , Активированный известь и другие.
C 2 H 5 O H ⟶ C H 3 C O H + H 2 {\ displaystyle \ mathrm {C_ {2} H_ {5} OH \ longrightarrow CH_ {3} COH + H_ {2}}}
Возможно образование ацетона при каталитическом окислении пропана кислородом воздуха при температуре 400 ° C:
C 3 H 8 + O 2 ⟶ CH 3 COCH 3 + H 2 O {\ displaystyle \ mathrm {C_ {3} H_ {8} + O_ {2} \ longrightarrow CH_ {3} COCH_ {3} + H_ {2} O}}
Ацетон имеет типичные химические свойства кетонов . Он тяжело окисляется, каталитически восстанавливается до изопропилового спирта , Реагирует по карбонильной группе с нуклеофилами и по α-позиции.
Окислительно-восстановительные реакции [ ред. | ред. код ]
При восстановлении ацетона щелочными реагентами и особенно амальгама магния или цинка происходит конденсация и восстановления, завершаются образованием пинакон :
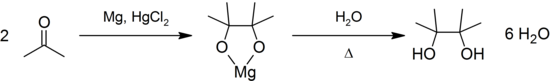
Ацетон окисляет вторичные спирты в кетоны в присутствии трет -бутилату алюминия ( реакция Опенауера [En] )
![Ацетон окисляет вторичные спирты в кетоны в присутствии трет -бутилату алюминия ( реакция Опенауера [En] )](/wp-content/uploads/2019/12/ru-wikizero-aceton-19.png)
При использовании большого избытка ацетона реакция сдвигается вправо.
под действием перекиси водорода на ацетон в кислой среде образуется перекись ацетона .
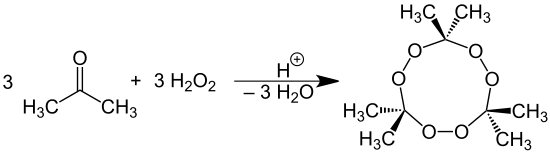
Хромовый ангидрид окисляет ацетон до углекислого газа и воды. Ацетон реагирует с аммиаком и водородом в присутствии никеля или меди , образуя амины :
CH 3 - CO - CH 3 + NH 3 + H 2 → N i CH 3 - CH (NH 2) - CH 3 + H 2 O {\ displaystyle \ mathrm {CH_ {3} {-} CO {-} CH_ { 3} + NH_ {3} + H_ {2} {\ xrightarrow {Ni}} \ CH_ {3} -CH (NH_ {2}) - CH_ {3} + H_ {2} O}}
Обычно реакция проходит при температуре 125-175 ° С и давлении 5-10 атмосфер.
Присоединение нуклеофилов к карбонильной группе [ ред. | ред. код ]
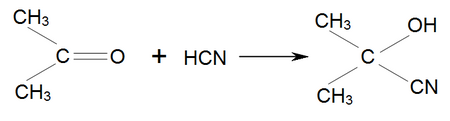
Одной из важнейших реакций ацетона является присоединение к нему синильной кислоты , В результате чего образуется ацетонциангидрин :
Аналогично ацетон присоединяет хлороформ , образуя хлоретон , Который применяется как антисептик :
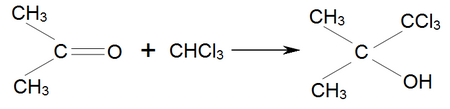
При конденсации с ацетиленом ацетон образует диметилкарбинол , Который легко превращается в изопрен :
(CH 3) 2 CO + CH ≡ CH → 5% N a OH, 95 - 100 o CHC ≡ C - C ((CH 3) 2) OH → H 2 {\ displaystyle \ mathrm {(CH_ {3}) _ {2} CO + CH {\ equiv} CH {\ xrightarrow {5 \% NaOH, \ 95-100 ^ {o} C}} \ HC {\ equiv} C {-} C ((CH_ {3}) _ {2}) OH {\ xrightarrow {H_ {2}}}}} H 2 C = CH - C ((CH 3) 2) OH → H 2 SO 4 H 2 C = CH - C (CH 3) = CH 2 + H 2 O {\ displaystyle \ mathrm {H_ {2} C { =} CH {-} C ((CH_ {3}) _ {2}) OH {\ xrightarrow {H_ {2} SO_ {4}}} \ H_ {2} C {=} CH {-} C (CH_ {3}) {=} CH_ {2} + H_ {2} O}}
Реакции по α-позиции [ ред. | ред. код ]
Как и в других алифатических кетонах, в ацетоне протоны на углероде соседнем с карбонильной группой довольно кислые и относительно легко вступают в реакции замещения как в кислой так и в щелочной среде. При воздействии на ацетон металлического натрия или амида натрия образуется ацетоннатрий - натриевый алкоголят изопропенилового спирта :
2 CH 3 - CO - CH 3 + 2 N a ⟶ 2 CH 2 = C (ON a) - CH 3 + H 2 {\ displaystyle \ mathrm {2CH_ {3} {-} CO {-} CH_ {3} + 2Na \ longrightarrow 2CH_ {2} {=} C (ONa) {-} CH_ {3} + H_ {2}}} CH 3 - CO - CH 3 + NH 2 N a ⟶ CH 2 = C (ON a) - CH 3 + NH 3 {\ displaystyle \ mathrm {CH_ {3} {-} CO {-} CH_ {3} + NH_ {2} Na \ longrightarrow CH_ {2} {=} C (ONa) {-} CH_ {3} + NH_ {3}}}
В присутствии щелочей ацетон легко реагирует с галоидов с образованием хлороформа , йодоформа и бромоформа :
CH 3 - CO - CH 3 + 4 N a OH + 3 C l 2 ⟶ CHC l 3 + CH 3 COON a + 3 N a C l + 3 H 2 O {\ displaystyle \ mathrm {CH_ {3} {-} CO {-} CH_ {3} + 4NaOH + 3Cl_ {2} \ longrightarrow CHCl_ {3} + CH_ {3} COONa + 3NaCl + 3H_ {2} O}}
Эта реакция протекает через промежуточное образование трихлорацетону.
Реакции в кислой среде проходят по другому механизму. Сначала протонуеться карбонильная группа, затем отрывается протон в α-позиции с образованием нейтрального Энола легко всутае в реакции присоединения.

Реакции конденсации [ ред. | ред. код ]
Реакции присоединения по карбонильной группе или по α-позиции, приводящие к образованию новых С-С связей называют реакциями конденсации. Поскольку в ацетоне присутствуют активная карбонильная группа и две активные метильные группы в α-позициях, он способен вступать в различные реакции конденсации. при Альдольная конденсации происходит образование диацетонового спирта , Который применяют как растворитель :
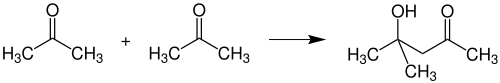
при кротоновый конденсации последовательно образуются оксид мезитилу , а потом Форон . Оксид мезитилу применяют для снижения летучести растворителей для лакокрасочных покрытий.
(CH 3) 2 CO + (CH 3) 2 CO → (COOH) 2, 120 o C (CH 3) 2 C = CH - C (O) - CH 3 + H 2 O {\ displaystyle \ mathrm {(CH_ {3}) _ {2} CO + (CH_ {3}) _ {2} CO {\ xrightarrow {(COOH) _ {2}, \ 120 ^ {o} C}} \ (CH_ {3}) _ { 2} C {=} CH {-} C (O) {-} CH_ {3} + H_ {2} O}} (CH 3) 2 C = CH - C (O) - CH 3 + (CH 3) 2 CO → N a OH, 150 - 170 o C (CH 3) 2 C = CH - C (O) - CH - C (CH 3) 2 + H 2 O {\ displaystyle \ mathrm {(CH_ {3}) _ {2} C {=} CH-C (O) -CH_ {3} + (CH_ {3}) _ {2 } CO {\ xrightarrow {NaOH, \ 150-170 ^ {o} C}} (CH_ {3}) _ {2} C {=} CH-C (O) -CH-C (CH_ {3}) _ {2} + H_ {2} O}}
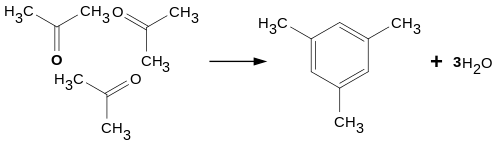
При конденсации трех молекул ацетона под действием концентрированной серной или соляной кислоты образуется симметричный триметилбензол ( мезитилен ):
При конденсации ацетона с формальдегидом в присутствии небольших количеств щелочей образуется ацетоспирт , Который при воздействии йода или кислот при нагревании легко отщепляет воду , Переходя в метилвинилкетон :
CH 3 - CO - CH 3 + CH 2 O ⟶ CH 3 - CO - CH 2 - CH 2 OH ⟶ CH 3 - CO - CH = CH 2 + H 2 O {\ displaystyle \ mathrm {CH_ {3} {-} CO {-} CH_ {3} + CH_ {2} O \ longrightarrow CH_ {3} {-} CO {-} CH_ {2} {-} CH_ {2} OH \ longrightarrow CH_ {3} {-} CO { -} CH {=} CH_ {2} + H_ {2} O}}
при конденсации уксусноэтиловый эфира с ацетоном получают ацетилацетон :
CH 3 COOC 2 H 5 + CH 3 - CO - CH 3 ⟶ CH 3 - CO - CH 2 - CO - CH 3 + C 2 H 5 OH {\ displaystyle \ mathrm {CH_ {3} COOC_ {2} H_ {5 } + CH_ {3} {-} CO {-} CH_ {3} \ longrightarrow CH_ {3} {-} CO {-} CH_ {2} {-} CO {-} CH_ {3} + C_ {2} H_ {5} OH}}
Другие реакции [ ред. | ред. код ]
при пиролизе ацетона (500-700 ° С) над глиноземом или на раскаленной электрическим током платиновом проводе в специальном приборе - кетенний лампе Образуется самый кетен :
2 CH 3 - CO - CH 3 + CH 2 = C (OH) - CH 3 ⟶ CH 2 = C = O + CH 4 {\ displaystyle \ mathrm {2CH_ {3} {-} CO {-} CH_ {3} + CH_ {2} {=} C (OH) {-} CH_ {3} \ longrightarrow CH_ {2} {=} C {=} O + CH_ {4}}}
Ацетон также вступает с аммиаком в реакцию Манниха с образованием 2,2 ', 6,6'-тетраметилпиперидону-4 с приемлемыми выходами.
Ацетон - очень хороший растворитель жиров , масел , Многих смол, нитролаков, сургуча , канифоли . Ацетон также растворяет ацетилен , целлулоид , нитро - и ацетилцеллюлозу . каучук , пек и мастичные смолы не растворяются в ацетоне.
Благодаря своей малой токсичности , Хорошей растворимой способности ацетон очень широко применяется на предприятиях химической чистки .
При конденсации ацетона в щелочной среде можно получить разнообразные продукты [30] . При температуре 10-20 ° С в метанольная растворе ацетон димеризуеться в присутствии небольших количеств щелочи в диацетоновый спирт , Из которого получают гексиленгликоль , оксид мезитилу , метилизобутилкарбинол , метилизобутилкетон , Метиловый эфир гексиленгликоль. Гексиленгликоль добавляется преимущественно к топливу. Оксид мезитилу способен вступать в различные реакции присоединения, например с метанолом в присутствии небольших количеств щелочи. Метилизобутилкетон - очень важный растворитель . Метилизобутилкетон и метилизобутилкарбинол очень хорошие растворителями для поливинилхлорида , сополимеров винилхлорида , производных целлюлозы , Хлорированного каучука и других веществ. В большинстве случаев за растворимыми способностями они превосходят эфиры .
При каталитической конденсации ацетона в присутствии оснований при 200 ° С рядом с так называемыми изоциклитонамы образуется изофорон , Который также является основой для различных синтезов. Сам изофорон занимает исключительное положение как растворитель виниловых лаков . Он предоставляет лакам горячей сушки блеска и прочности. При осторожном гидрировании с изофорон получают 3,3,5-триметилциклогексанон, который применяется на получение перекисей и служит растворителем. 3,3,5-триметилциклогексанол, который образуется в результате полной гидрогенизации изофорон, является важным компонентом специальных пластификаторов , Особенно во взаимодействии с длинноцепочечных алифатических моно- и дикарбоновых кислотами. Но еще большее значение придают продукту его окисления нитратной кислотой - α, α, γ-триметиладипиновий кислоте. Эту кислоту етерефикують в специальные пластификаторы и превращают через диметиловый эфир в 2,2,4-триметилгександиол-1, 6 путем энергичной гидрогенизации. Кроме того, кислоту можно превратить гидрогенизацией динитрила в 2,2,4-триметилгексаметилендиамин.
Другой путь получения диамина с изофорон заключается в воздействии на него синильной кислоты и образовании нитрила изофорон - 3,3,5-триметил-5-цианоциклогексанону, который при специальных условиях можно восстановить в 1-аминометил-1,3,3-триметил-5-аминоциклогексан ( изофорондиамин ). Диамины легко перевести в диизоцианатов и дальше использовать как отвердители эпоксидных смол . Особенно велика их роль для изготовления прозрачных полиамидов . Полиамиды применяются для изготовления смол, связных компонентов лаков, клеев , высококачественных пластмасс .
Также в органическом синтезе из ацетона добывают кетен , изопрен тому подобное.
Патофизиологически влияние [ ред. | ред. код ]
Общий характер действия [ ред. | ред. код ]
наркотик Последовательно поражает все отделы центральной нервной системы . При вдыхании в течение длительного времени накапливается в организме. токсический эффект зависит не только от концентрации, но и от времени действия. Медленное выделение из организма увеличивает возможности хронического отравления. Подавляет некоторые митохондриальные (окислительные) ферменты [31] .
Влияние на животных [ ред. | ред. код ]
При остром отравлении в белых мышей боковое положение после 2-часовой экспозиции наступает при 30-40 мг / л [32] ; смерть - при 150 мг / л. В белых крыс боковое положение при 2-часовом воздействии 30 мг / л. Концентрации до 10 мг / л не оказывает влияния даже через 8:00. первые признаки отравления установленные при 25 мг / л через 1,5-3 часа. При 50 мг / л рефлексы исчезают через 2-2,5 часа. В морских свинок и кроликов боковое положение наступало при 2-часовом воздействии 72 мг / л. Минимальные концентрации, изменяющие безумовнорефлекторну деятельность кроликов, 1,25-2,5 мг / л. У мышей, крыс, морских свинок и кроликов концентрации ацетона, вызвавшие боковое положение, приводили к увеличению содержания ацетона, ацетоуксусной и особенно β- оксимасляной кислоты в крови и мочи [32] . В кошек вдыхание 8-10 мг / л в течение 5:00 вызывает только раздражение слизистых оболочек носа и глаз , Сонливость. В собак при 5-6 мг / л и экспозиции 7:00 условные рефлексы не изменяются.
При исследованиях хронического отравления белым крысам давали вдыхать 0,00053 мг / л ацетона непрерывно в течение 45 суток или 0,2 мг / л в день по 8:00. В результате не было обнаружено существенных признаков отравления [33] . Влияние 0,019 мг / л по 4:00 в день в течение 3 недель не изменило условнорефлекторной деятельности [34] . Животные выдерживали действие ацетона в течение 9 дней при концентрации в крови 100 мг% и не проявляли никаких признаков отравления, если не учитывать некоторой сонливости. При 250 мг% ацетона в крови - слабость и расстройство координации движений. В мышей и кроликов при ежедневных 4-часовых отравлениях концентрацией 8 мг / л в течение более 3 месяцев развивалось повышение чувствительности к ацетона с ухудшением общего состояния. По другим данным, наоборот, при вдыхании в течение 40 минут 1-2 раза в неделю растущих с 1 до 4 мг / л концентраций наблюдалось «привыкания» [35] [36] . Содержание ацетона в крови «привыкших» животных при одной и той же концентрации в воздухе был ниже, чем у тех, которые впервые его вдыхали [37] . В кошек повторное отравление 3-5 мг / л - вызвало лишь раздражение слизистых оболочек.
Влияние на человека [ ред. | ред. код ]
Порог восприятия запаха составляет 0,0011 мг / л, порог действия, влечет возникновение електрокортикального условного рефлекса, 0,44 мг / л [33] . При вдыхании 1,2 мг / л в течение 3-5 минут происходит раздражение слизистых оболочек глаз , носа и горла , А вдыхание 0,01 мг / л в течение 6:00 повышало активность холинэстеразы крови и коэффициент использования кислорода . Увеличение содержания в крови кетоновых тел происходило и при воздействии 0,001 мг / л; в мочи содержание кетоновых тел не менялся [38] .
В случае острого отравления , У пострадавшего содержание ацетона в крови на второй день достигал 18 мг% (норма 1-2 мг%). Ацетон был обнаружен также и в моче; через некоторое время в моче обнаруживали небольшое количество белка , лейкоциты и эритроциты . Уровень сахара в крови в день отравления достигал 142 мг% [39] .
При одновременном содержании в воздухе 2,3-3 мг / л ацетона и бутанон отмечены случаи обморока у работниц. При применении в качестве растворителя ацетона вместе с бутанон описанное отравления нескольких рабочих (недомогание, слезотечение , Непродолжительная потеря сознания, сопровождавшаяся судорогами , головная боль ). Массовое острое заболевание глаз у рабочих обувной фабрики (светобоязнь, слезотечение, конъюнктивиты а также расстройство зрения) было вызвано ацетонистим спиртом и зависело, очевидно, не столько от ацетона, сколько от метилового и аллилового спиртов. Аналогичные заболевания объяснялись загрязнением ацетона ацетальдегидом .
По наблюдениям в ходе исследований хронических отравлений при концентрации 0,1-0,12 мг / л ацетона в рабочих не наблюдалось никаких признаков отравления, хотя в моче он постоянно определялся; при 0,5-1 мг / л ацетон в крови не определялся в течение недели. Концентрация 5 мг / л в воздухе при ежедневном воздействии вызвала возникновение в крови до 40 мг% ацетона. При наличии ~ 0,6 мг / л ацетона в воздухе (в присутствии бутилацетата и этилового спирта ) Отмечались признаки отравления. Наблюдались изменения со стороны верхних дыхательных путей , Чаще в форме атрофических катаров, анемия , Сдвиг влево лейкоцитарной формулы , снижение аппетита . В некоторых рабочих в сыворотке крови было выявлено снижение уровня альбуминов и повышение уровня α-, β- и γ- глобулинов , А также общих липидва Без других симптомов интоксикации .
Воздействие на кожу [ ред. | ред. код ]
при погружении уши кролика в ацетон на 3:00 или при нанесении чистого ацетона на выстриженный кожу живота на 6:00 местного действия почти незаметно. При наложении компрессов с ацетона обнаружены изменения в периферической нервной системе , Наиболее чувствительными оказываются мозговые нервные волокна.
Компрессы из ацетона, наложенные человеку на плечо на сутки , Вызвали незначительное покраснение, которое вскоре исчезало. В рабочих на участках кожи, на которые в течение рабочего дня действовал ацетон, уменьшался pH и количество холестерина , Подавлялась функция сальных желез [40] .
Попадание в организм и поведение в нем [ ред. | ред. код ]
жидкий ацетон может всасываться через кожу. Ацетон появляется в крови сразу после начала вдыхания его концентрация постепенно нарастает к установлению динамического равновесия. содержание в тканях составляет следующий ряд: головной мозг → селезенка → печень → поджелудочная железа → почки → легкие → мышцы → сердце . меченый углерод , Что входит в молекулу ацетона, обнаруженный в составе гликогена , мочи , холестерина , жирных и аминокислот . ацетон метаболизируется полнее при вдыхании невысоких концентраций. С выдыхаемым воздухом, выделяется неизмененный ацетон, а при его окислении образуется CO 2 {\ displaystyle \ mathrm {CO_ {2}}} . Ацетон выделяется также через почки и кожу [41] .
«Анализ на ацетон» [ ред. | ред. код ]
ацетон, ацетоуксусная и бетаоксимасляна кислота , Объединяются под общим названием кетоновые тела . Это продукты неполного окисления жиров и частично белков , Тесно связаны между собой.
При нормальном состоянии организма кетоновые тела в общем анализе мочи отсутствуют. Следует отметить, что за сутки с мочой таки выделяется незначительное количество этих соединений, однако такие концентрации не могут быть определены обычными методами, которые применяются в лабораториях. Поэтому принято считать, что в норме в моче ацетоновых тел нет.
Кетоновые тела оказываются в общем анализе мочи при нарушении обмена углеводов и жиров. Такое нарушение сопровождается увеличением количества ацетоновых тел в тканях в крови ( кетонемия ). Содержание в моче ацетоновых тел называется кетонурии .
При нормальных условиях организм черпает энергию в основном из глюкозы . Глюкоза накапливается в организме, в первую очередь в печени В виде гликогена . Гликоген образует энергетический резерв, который можно быстро мобилизовать при необходимости компенсации внезапной нехватки глюкозы.
При физических и эмоциональных нагрузках, при болезнях с повышенной температурой и других повышенных затратах энергии запасы гликогена исчерпываются, организм начинает получать энергию из запасов жира. При распаде жира образуются кетоновые тела , Которые выводятся из мочой . Если с ацетоновая телами в общем анализе мочи обнаруживается глюкоза, то это признак сахарного диабета . Также кетоновые тела в общем анализе мочи появляются в результате обезвоживания организма При резком похудении, горячке , Голодании, тяжелых отравлениях с сильной рвотой и поносом .
- ↑ а б в CRC Handbook of Chemistry and Physics / Lide, DR, editor. - 86th. - Boca Raton (FL): CRC Press, 2005. - 2656 p. - ISBN 0-8493-0486-5 . (Англ.)
- ↑ Howard, William L. Acetone // Kirk-Othmer Encyclopedia of Chemical Technology. - 4th. - New York: John Wiley & Sons, 2004. - P. 93. - ISBN 978-0-471-48517-9 . - DOI : 10.1002 / 0471238961.0103052008152301.a01 . (Англ.)
- ↑ Березов Т. Т., Коровкин Б.Ф., Биологическая химия: Учебник / Под. ред. акад. АМН СССР С. С. Дебова.- второй изд., Перераб. и доп М .: Медицина, - 1990.- 528 с. ISBN 5-225-01515-8 (Рус.)
- ↑ Постановление Кабинета министров Украины №770 от 6 мая 2000 года «Об утверждении перечня наркотических средств, психотропных веществ и прекурсоров»
- ↑ Ullmann, Enzyklopadie der technischen Chemie, München, Bd. 1, 1951, S. 106. (нем.)
- ↑ патент США 1329214, 1920 (англ.)
- ↑ JH Northrop et al., Industrial & Engineering Chemistry, 11, 723 (1919). (Англ.)
- ↑ WH Peterson et al., Industrial & Engineering Chemistry, 13 757 (1921). (Англ.)
- ↑ немецкий патент 298851, 1916 (нем.)
- ↑ английский патент 299048, 1928 (англ.)
- ↑ английский патент 313897, 1928 (англ.)
- ↑ английский патент 330350, 1929 (англ.)
- ↑ английский патент 472093, 1936 (англ.)
- ↑ английский патент 173539, 1920 (англ.)
- ↑ патент США 1365035, 1918 (англ.)
- ↑ патент США 1497817, 1918 (англ.)
- ↑ патент США 1952702, 1933 (англ.)
- ↑ патент США 1895516, 1933 (англ.)
- ↑ патент США 1895528, 1933 (англ.)
- ↑ патент США 1895529, 1933 (англ.)
- ↑ J. Smidt et. al., Angewandte Chemie, 71, 176-182 (1959). (Нем.)
- ↑ W. Hafner et al., Chemische Berichte, 95, 1575-1581 (1962). (Нем.)
- ↑ J. Smidt, H. Krekeler, Erdol und Kohle, 16 (6-1), 560-563 (1963). (Нем.)
- ↑ J. Smidt, Chemistry & Industry, 1962, 54-61. (Англ.)
- ↑ английский патент 884962, 1961. (англ.)
- ↑ английский патент 878777, 1961. (англ.)
- ↑ бельгийский патент 620834, 1963 (фр.)
- ↑ французский патент 1397639, 1965 (фр.)
- ↑ итальянский патент 640465, 1962 (итал.)
- ↑ К. Schmitt, Chemische Industrie, 18 № 4, 204-210 (1966). (Нем.)
- ↑ Clark H., Powis G. Biochemical Pharmacology, 1974, v. 23. № 5, p. 1015-1019. (Англ.)
- ↑ а б Линючева Л. А. и др. Фармакология и токсикология, 1969, № 4, с. 465-467. (Рус.)
- ↑ а б Фельдман Ю. Г. В кн .: Предельно допустимые концентрации атмосферных загрязнений. Вып. 6. М., 1962, с. 109-127. (Рус.)
- ↑ Batting К., Grandjen Е. Archives of Environmental Health, 1964, v. 9. № 6, p. 745-749. (Англ.)
- ↑ Кулинченко В. П. В кн .: Конференция молодых научных работников. Тезисы докладов. Институтт гигиены труда и проф. заболев. АМН СССР, 1964, с. 30-31. (Рус.)
- ↑ Олюпин И. В., Проблемы гигиены труда и проф. заболев. Вып. I. Иркутск, 1964, с, 12-19 ;: 20-31. (Рус.)
- ↑ Добрынина В. В. В кн .: Материалы II конференции молодых научных работников. Лен. ин-та гиг. труда и проф. заболев. Л. 1968, с. 46-49. (Рус.)
- ↑ Михайлов В. И., Пилипюк С. И. Гигиена труда, 1968, № 1, с. 57-60. (Рус.)
- ↑ Ross DS The Annals of Occupational Hygiene , 1973, v. 16 № 1, p. 73-75. (Англ.)
- ↑ Рогайлин В. И. Гигиена труда, 1966, № 2, с. 23-25. (Рус.)
- ↑ Eagle J., American Industrial Hygiene Association Journal, 1973, v. 34, № 12, p. 533-539. (Англ.)
- Андреас Ф., Гребе К. Химия и технология пропилена. - Ленинград: Химия, 1973. - 368 с. (Рус.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под. ред. Лазарев Н. В. и Левиной Э. Н. - Ленинград: Химия, 1976. - Т. 1. - С. 529-533. - 49000 экз. (Рус.)
- Шейхет Ф. И. Материаловедение химикатов, красителей и моющих средств. - Москва: Легкая индустрия, 1969. - С. 62-71. - 18000 экз. (Рус.)
- Химическая энциклопедия / Под. ред. Кнунянц И. Л. - Москва: Советская энциклопедия, 1988. - Т. 1. (рус.)
- Теддер Дж., Нехватало А., Джуббы А. Промышленная органическая химия. - Москва: Мир, 1977. - 704 с. (Рус.)

